Sinds de introductie van antibiotica in de geneeskunde in de jaren ’40, is de resistentie tegen antibiotica in een alarmerend tempo toegenomen. Het vormt nu een grote bedreiging voor de volksgezondheid. Het probleem in chronische wonden is dat bacteriën zich ontwikkelen tot biofilms. In deze biofilms worden bacteriën beschermd tegen antimicrobiële middelen (zoals antibiotica); dit wordt biofilmtolerantie genoemd (Ref 1). In deze blog behandelen we de uitdagingen van een biofilm.
De formatie van biofilms
Alle open wonden bevatten bacteriën. Chronische wonden zijn open wonden die niet genezen, zoals bij een diabetische voet of een open been (ulcus cruris) bijvoorbeeld door veneuze insufficiëntie. In de vroege stadia van het ontstaan van een chronische wond worden de vrij zwevende (planktonische) bacteriën over het algemeen vernietigd door het immuunsysteem. Bacteriën hebben echter de voorkeur om aan elkaar te gaan hechten, om zo biofilms te vormen (zie Figuur 1). De bacteriën in een biofilm hechten aan elkaar en produceren een extracellulaire biofilm matrix. Dit zorgt voor extra bescherming van invloeden van buitenaf (Ref 2). Twee algemeen bekende voorbeelden van een biofilm zijn tandplak en de slijmerige laag in een voederbak van een hond.
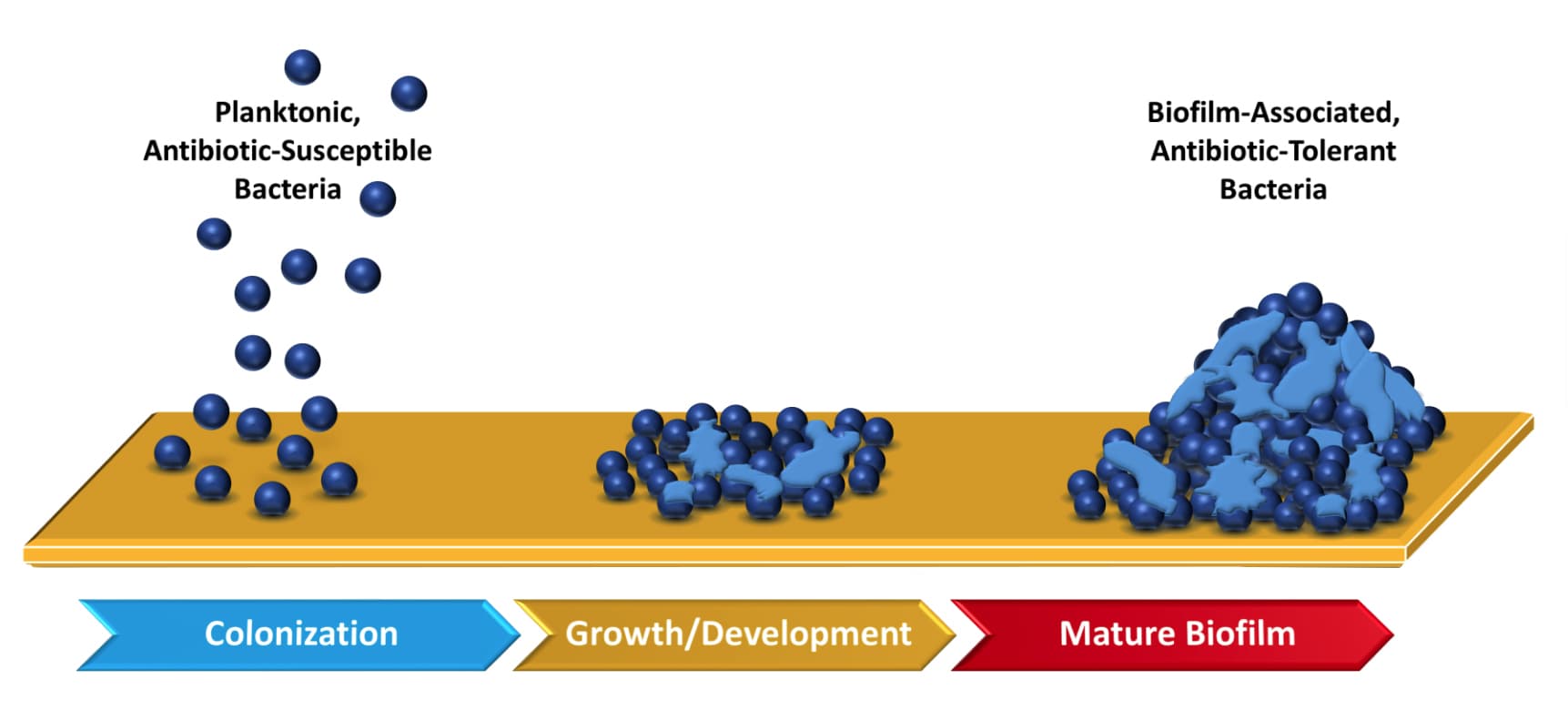
Figuur 1: Illustratie van de ontwikkeling van een biofilm. Van planktonische bacteriën tot de ontwikkeling van een volwassen biofilm. Overgenomen uit Ref 3.
Waarom biofilms problematische infecties veroorzaken
Bewijs laat zien dat biofilms een belangrijke rol spelen bij het onvermogen van chronische wonden om te genezen (Ref 5). Biofilms zijn aanwezig in slechts 6% van de acute wonden, maar in meer dan 90% van de chronische wonden (Ref 5). Jonge biofilms zijn veel gevoeliger voor antibiotica dan volwassen biofilms. Daarom is het belangrijk om vroeg te starten met de behandeling van biofilminfecties (Ref 6).
De voornaamste reden waarom biofilms problematische infecties veroorzaken is het vermogen om antibiotica en componenten van het immuunsysteem te verdragen. De huidige antibiotica kunnen het aantal bacteriën in een biofilm reduceren, maar kunnen de biofilm niet compleet laten verdwijnen. Dit resulteert in een terugkeer van biofilminfecties (Ref 6), met als gevolg: de wond gaat niet dicht. Verder heeft elke biofilm verschillende kenmerken, zodat een klinische aanpak moet worden afgestemd op de specifieke kenmerken van een bepaalde biofilm. Dit maakt het moeilijk om een biofilm te behandelen (Ref 5).
Hoe moeten biofilms behandeld worden?
Helaas zijn de meeste van de huidige behandelmethodes ontwikkeld om acute infecties tegen te gaan, die, in tegenstelling tot chronische infecties, de neiging hebben snel te ontstaan en maar van korte duur zijn.
Planktonische bacteriën reageren over het algemeen goed op antibiotica en worden gemakkelijk uitgeroeid door een gezond immuunsysteem. Volwassen biofilms kunnen zich in chronische wonden binnen 10 uur ontwikkelen en blijven bestaan zolang de wond open blijft. In een klinische studie is daarnaast aangetoond dat ondanks het effectief verwijderen van biofilms in chronische wonden door chirurgisch debridement, de biofilms na twee dagen weer terugkeren. Drie dagen na debridement werden volwassen biofilms, met hoge aantallen bacteriën, geïdentificeerd. Dit laat zien dat er maar een kleine tijdspanne is waarbij de planktonische bacteriën die de open wond opnieuw koloniseren vatbaar zijn voor de reguliere antimicrobiële of andere behandelingen (Ref 4).
Huidige therapieën en therapieën in ontwikkeling zijn vaak een combinatie van debridement, om de biofilm te verwijderen, en een andere therapie om te voorkomen dat de biofilm terugkomt (Ref 7). Als additionele therapie zouden antimicrobiële middelen of innovatieve strategieën gebruikt kunnen worden. Met de opkomst van antimicrobiële resistentie en biofilmtolerantie, zouden innovatieve strategieën zoals koud plasma (geïoniseerd gas) beschreven in Ref 8, Ref 9 en Ref 10 een uitkomst kunnen bieden. Andere innovatieve strategieën zijn ook beschreven, zie Ref 4.
Koud plasma om biofilms te beheersen
Verschillende in vitro en in vivo studies hebben de antimicrobiële potentie van koud plasma laten zien, niet alleen tegen individuele bacteriën, maar ook tegen antibioticaresistente bacteriën en biofilms (Ref 11). Aangenomen wordt dat de ontwikkeling van bacteriële resistentie met koud plasma onwaarschijnlijk is. Koud plasma heeft ongetwijfeld de potentie laten zien voor het beheersen van biofilmgerelateerde infecties.
Verder is er aangetoond dat koud plasma, behalve zijn antibacteriële effect, ook herstel van weefsel (granulatieweefsel) bevordert en de lokale bloedtoevoer stimuleert (Ref 8).
Conclusie: aanvullende nieuwe strategieën kunnen een uitkomst bieden voor de behandeling van chronische wonden
Het snel terugkeren van biofilm en tolerantie tegen antibiotica is problematisch voor de behandeling van chronische wonden. Daarom kunnen aanvullende nieuwe strategieën, zoals koud plasma, een uitkomst bieden. Het is van het grootste belang dat effectieve behandeling toegepast wordt binnen 2 tot 3 dagen na debridement, de tijdsspanne voordat de biofilm weer terugkeert.
Maken jullie onderscheid tussen wonden die planktonische bacteriën bevatten of biofilms? Indien ja, wat doen jullie om biofilms te behandelen? Plaats hieronder uw reactie.
Nieuwe blogs worden vermeld in onze nieuwsbrief. Hieronder kun je je inschrijven.
Referenties:
1 Bowler P.G. (2018). Antibiotic resistance and biofilm tolerance. A combined threat in the treatment of chronic infections. Journal of wound care 27 (5):273-277
2 Collette H Thomson (2010). Biofilms: do they affect wound healing? International Wound Journal 8(1).
3 Aaron T. Garrison and Robert W. Huigens (2017). Eradicating Bacterial Biofilms with Natural Products and their Inspired Analogues that Operate Through Unique Mechanisms. Current Topics in Medicinal Chemistry 17(14): 1-8
4 Omar et al. (2017). Microbial Biofilms and Chronic Wounds. Microorganisms 5(9)
5 Attinger and Wolcott (2012). Clinically Addressing Biofilm in Chronic Wounds, Advances in wound care 1(3): 127-132
6 Ciofu and Tolker-Nielsen (2019). Tolerance and Resistance of Pseudomonas aeruginosa Biofilms to Antimicrobial agents – How P. aeruginosa Can Escape Antibiotics. Frontiers in Microbiology 10: Article 913
7 Metcalf D.G. and Bowler P.G. (2013). Biofilm delays wound healing: A review of the evidence. Burns & Trauma 1 (1): 5-12
8 Whitepaper. Stimuleren van wondgenezing met koud plasma: https://www.plasmacure.nl/en/whitepaper/
9 Wiegand C. (2019). Potential of cold atmospheric pressure plasma (CAPP) in wound management. Wounds International 10 (4): 26-31
10 Metelmann H.R. et al. (2018). Comprehensive clinical plasma medicine: Cold Physical Plasma for Medical Application
11 Padrig B Flynn and Brendan F Gilmore (2018). Understanding plasma biofilm interactions for controlling infection and virulence, Journal of Physics D: Applied Physics, 51 263001
Deze artikelen zijn geïnterpreteerd door mensen van Plasmacure B.V.. Vragen naar aanleiding van deze blog worden door onze wonddeskundigen beantwoord. Mail naar blog@plasmacure.nl


Reageren